Informe hecho por:
-Fernando de los Santos
-Alejandro Diaz
-Gastón Muiño
6º Físico-Matemático. Química. Colegio Ingles 2014.
Profesor Roberto Calvo
Fuentes varias
domingo, 15 de junio de 2014
Informe
Química Practico: (ensayo de reconocimiento de proteínas):
Proteínas:
Las proteínas son macromoléculas compuestas en su mayoría por carbono,
hidrógeno, oxígeno y nitrógeno, entre otros. Las mismas están formadas por la
unión de aminoácidos, unidos mediante enlaces peptídicos. La disposición y
orden de los aminoñacidos en una proteína dependerá del
código genético (ADN).
Las
proteínas ocupan un lugar de máxima importancia entre las moléculas
constituyentes de los seres vivos (biomoléculas). Prácticamente no existe proceso biológico alguno
que no dependa de la participación de las proteínas.
Las proteínas o prótidos están
presentes en todas las células vivas y alrededor de un 50% del peso seco del
cuerpo humano se compone de proteínas. Las proteínas son los componentes
estructurales principales de los tejidos animales, son parte fundamental de la
piel, uñas, cartílagos y músculos. Otras proteínas catalizan reacciones,
transportan oxígeno, sirven como hormonas para regular procesos corporales
específicos y llevan a cabo otras tareas.
Informe de la actividad experimental
Objetivo:
El objetivo de esta práctica es reconocer la naturaleza
proteica de algunas sustancias tales como: caseína, ovoalbúmina, gelatina,
aspartamo, glicina y suero. Para ello utilizaremos los ensayos de Biuret y
Xantoproteica.
Materiales:
sábado, 14 de junio de 2014
Caseina
INFORMACION
DE LA ESTRUCTURA Y FUNCION DE LAS MUESTRAS SOMETIDAS A PRUEBA
Caseina
La
leche es:
a)
Una emulsión de materia grasa (principalmente triacilglicéridos) en
un medio acuoso.
b)
una suspensión de materia proteica (caseína,
albumina, globulina) en un medio acuoso.
c)
una solución acuosa de sales minerales y lactosa.
Contiene
además menores de lecitina, vitaminas, enzimas, nuclétidos, y gases disueltos.
La
composición es variable según la especie considerada.
Dentro
de los componentes proteicos encontramos:
1)
Caseína: complejo de proteínas fosforadas. Constituye el 80% del total de los compuestos
nitrogenados.
2)
Proteínas de lactosuero: albuminas y globulinas. Se insolubilizan por acción
del calor antes de los 100 ºC
3)
Proteosas- peptonas: Glicoproteínas poco abundantes en la leche.
La caseína es
un complejo de proteínas fosforadas. Esta constituye el 80% de los compuestos nitrogenados. La caseína es una proteína de la leche del tipo fosfoproteína que se
separa de la leche por acidificación y forma una masa blanca. Las
fosfoproteínas son un grupo de proteínas que están químicamente unidas a una
sustancia que contiene ácido fosfórico, por lo tanto su molécula contiene un
elemento fósforo.
Algunas de sus
utilidades
La caseína generalmente
se emplea en la industria para la fabricación de pinturas especiales y el
preparación de tejidos, clarificación de vino, elaboración de preparados
farmacéuticos, la fabricación de plásticos (botonería, peines y mangos de
utensilios), pinturas, la cual ha sido usada desde la antigüedad por los
egipcios, pegamento en relojería, carpintería (recomendadas para maderas
terciadas), papel, vidrio, porcelana.
PROCEDIMIENTO PARA LA
OBTENCION DE LA CASEINA
1) Colocar aproximadamente 25 ml de leche descremada en un vaso de Bohemia.
2) Calentar hasta aproximadamente 40°C agitando con varilla de vidrio.
3) Agregar ácido etanoico 2,0 M (gota a gota) agitando de forma continua
hasta coagulación total.
4) Separar el coagulo de caseína con la ayuda del papel filtro (foto del
coagulo).
5) Secar cuidadosamente la caseína con la ayuda del papel filtro.
6) Separar dos porciones del solido obtenido de aproximadamente 1cm3 y colocarlas en dos
tubos de ensayo
 |
| Coagulos de caseina |
Caracterización
·
Reacción de Biuret: agregue sobre la caseína de uno
de los tubos 20 gotas de NaOH al 10%. Luego agregue 2 gotas de solución CuSO4 al 1%.

·
Reacción xantoproteica: agregue sobre la caseína
del segundo tubo de ensayo 10 gotas de HNO3 concentrado. Espere un
par de minutos y anote las observaciónes.
·
CONCLUSIONES
DE LA CASEINA
Al hacer
biuret da positivo, ya que se torna violeta. Debido a esto concluimos que tiene
por lo menos dos enlaces peptídicos.
Con el ensayo
xantoproteico la muestra se torna una coloración amarrilla por lo cual también da positivo, esto es debido a que posee al menos un anillo
aromático.
viernes, 13 de junio de 2014
Ovoalbumina
 La ovoalbúmina es la principal proteína de la clara del
huevo (60-65% de las proteínas totales). Pertenece a la súper familia
proteínica de las serpinas (Las serpinas son un grupo numeroso de proteínas con
estructuras similares identificados inicialmente como capaces de inhibir otras
enzimas del grupo de las proteasas. El nombre serpina deriva de la combinación
de serina proteasa inhibitoria debido a sus propiedades funcionales).
La ovoalbúmina es la principal proteína de la clara del
huevo (60-65% de las proteínas totales). Pertenece a la súper familia
proteínica de las serpinas (Las serpinas son un grupo numeroso de proteínas con
estructuras similares identificados inicialmente como capaces de inhibir otras
enzimas del grupo de las proteasas. El nombre serpina deriva de la combinación
de serina proteasa inhibitoria debido a sus propiedades funcionales).
Pese a que la ovoalbúmina es considerada un serpina a
diferencia de la mayoría de éstas la ovoalbúmina no es capaz de inhibir
cualquier peptídasa.
Además es una glicoproteína. Las glicoproteínas son
moléculas compuestas por una proteína unida a uno o varios glúcidos, simples o
compuestos. En el caso particular de la ovoalbúmina lleva enlazada contenidos
diversos de glúcidos a la cadena de aminoácidos. Además de ser una glicoproteína la ovoalbúmina es una fosfoglicoproteína de
385 aminoácidos.
Se desnaturaliza por calor a los 78ºC perdiendo su
estructura replegada de albúmina y produciendo un gel con gran retención de
agua. Además es la proteína de mayor valor biológico ya que tiene muchos de los
nueve aminoácidos esenciales.
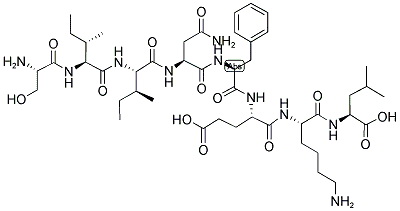 Presenta grupos sulfhidrilos (es la única de las proteínas
de huevo que posee esta característica) y se puede decir que la presencia de
estos grupos sulfhidrilos hacen una gran contribución aparte del sabor, textura
y aroma característicos del huevo.
Presenta grupos sulfhidrilos (es la única de las proteínas
de huevo que posee esta característica) y se puede decir que la presencia de
estos grupos sulfhidrilos hacen una gran contribución aparte del sabor, textura
y aroma característicos del huevo.
La ovoalbúmina es insoluble en agua pero es soluble en
soluciones alcalinas además otra de sus propiedades es que es resistente a
tratamientos térmicos suaves (coagula a 80 °C) y es rica en cisteína y
metionina.
ALGUNAS DE SUS FUNCIONES
La función biológica
de la ovoalbúmina es desconocida, aunque se presume que sea una reserva de
proteínas para la cría del ave. Otros autores señalan que es un mecanismo
protector contra las bacterias exteriores agresoras al huevo. Es una proteína
de referencia en bioquímica y es conocida en la industria alimenticia por sus
propiedades como transportadora, estabilizadora y formadora de emulsiones.
PROCEDIMIENTO CON LA OVOALBUMINA EN NUESTRA PRÁCTICA
1) Romper un huevo
2) Separar la yema de la clara
3) Colocar la clara en agua
4) Tomamos en dos tubos de ensayos muestras de la clara
diluida en agua
5) Sometemos las muestras a los ensayos de biuret y
xantoproteico
Caracterización
• Reacción
de Biuret: agregue sobre la ovoalbúmina de uno de los tubos 20 gotas de NaOH al
10%. Luego agregue 4 gotas de solución CuSO4
al 1%.
Nota: se nos indicó que para la reacción de biuret en lugar
de introducir 2 gotas de CuSO4 al 1% introdujéramos 4 gotas de dicha sustancia.
• Reacción
xantoproteica: agregue sobre la ovoalbúmina del segundo tubo de ensayo 10 gotas
de HNO3 concentrado. Espere un par de minutos y anote las observaciónes.
Conclusiones
La ovoalbúmina tras ser sometida al ensayo de biuret se
torna de un color violeta y tras ser sometida al ensayo xantoproteico se torna
de un color amarrillo, es decir el resultado de los dos ensayos es positivo,
por lo cual tiene más de dos enlaces peptídicos y haberse tornado amarrilla
tras el ensayo xantoproteico identificamos en la ovoalbúmina la presencia de
restos aromáticos, en particular el grupo fenólico de la tirosina.
Suscribirse a:
Entradas (Atom)



















